Vydání 3/ 2025
Kazuistika 1/2015
Honzák R.1,2,3, Strunzová V.1, Janoušková L.1, Moravcová M.1: Mánie po klarithromycinu
- Psychiatrická nemocnice Bohnice; ředitel MUDr. M. Hollý
- IKEM Praha; ředitel MUDr. A. Herman, Ph.D.
- Ústav všeobecného lékařství 1 LF UK v Praze; přednosta doc. MUDr. B. Seifert, Ph.D.
Souhrn: Autoři předkládají kazuistiku „antibiomanie“ u 55leté pacientky s emočně nestabilní poruchou osobnosti a mentální anorexií v anamnéze, nyní dlouhodobě ambulantně léčenou pro úzkostnou a depresivní symptomatologii, související se závažnou somatickou nemocí manžela.
Přesmyk do mánie nastal po druhé 500mg dávce klarithromycinu. Nicméně ten byl již třetím podaným antibiotikem v intervalu posledních čtyř měsíců. Manické symptomy dosáhly takové intenzity, že byla nutná nedobrovolná hospitalizace v psychiatrické nemocnici. Zde příznaky odezněly do týdne.
Autoři nabízejí hypotézu patogeneze manického zvratu. Předpokládají, že přesmyk mohl nastat primárně v důsledku alterace střevního mikrobiomu antibiotiky. Další patogenetická cesta může vést buď přes přímé vagové dráždění, nebo přes zvýšenou propustnost střevní bariéry pro falešné neurotransmitery.
Klíčová slova: Mánie – antibiomania – klarithromycin – střevní mikrobiom
Summary: Honzák R., Strunzová V., Janoušková L., Moravcová M.: Clarithromycin induced mania, PSYCHOSOM 2015; 13(1), pp. 8-22
The authors present a case of antibiomania in 55years woman with borderline personality, anorexia nervosa in personal history, and long lasting anxious and depressive symptomatology associated with husband´s serious illness.
Switch to mania occured after two 500mg doses of clarithromycin. However, clarithromycin was the third antibiotic administered in the last four months. Manic symptoms were so severe that involuntary hospitalization was required. Signs of mania disappeared within a week on psychiatric ward.
The authors submit the hypothesis that the pathogenetic pathway of sudden reversal into mania may be triggered by intestinal dysmicrobia after clarithromycine administration and then proceeded to CNS through either a leaky gut or direct stimulation of the nervus vagus.
Key words: antibiomania – mania – clarithromycin – gut microbioma
ÚVOD

Bipolární porucha je závažné onemocnění s těžko předvídatelným průběhem, a to i tehdy, je-li léčena lege artis a pacienti dodržují předepsaný režim. Stresující životní události, jimž se nelze vyhnout, často předcházejí depresivní epizodě a zvrat do mánie může vyvolat řada okolností, počínaje sezonními vlivy kolem rovnodennosti a konče jednou probdělou nocí. Z čistě biologického hlediska se na tomto zvratu mohou podílet všechny faktory, které působí na metabolismus a aktivitu monoaminů, acetylcholinu, aminokyselin, kortizolu, hormonů štítné žlázy a melatoninu (1). Tyto systémy mohou být ovlivněny jak přímo (např. relativně vysokou udržovací dávkou antidepresiv, léčebným podáváním kortikoidů), tak nepřímo – zásahem do jiných systémů, které jsou s těmito funkčně provázány. Zajímavým způsobem se na narušení křehké rovnováhy mohou podílet antibiotika. Publikace o výskytu manické epizody v souvislosti s podáním antibiotik pacientům trpícím bipolární poruchou, ale i lidem bez této anamnézy, dokonce u tříletého dítěte (2), se objevují sice ojediněle, ale na druhé straně již nejsou raritou a klinický obraz je často shrnován pod název antibiomania (antimicrobial-induced mania). V přehledu z roku 2002 popsal Abouesh se spolupracovníky 21 případů nalezených v databázi MEDLINE a z materiálů WHO získal popis 82 případů. Jako nejčastější etiopatogenetický činitel je v obou souborech uveden klarithromycin, v prvním případě šestkrát a ve druhém třiadvacetkrát (3). Nám se podařilo v databázi PubMed dohledat od roku 2002 do dneška celkem 13 popsaných případů antibiomanie a na jejím rozvoji se klarithromycin podílel celkem sedmkrát (2, 4-9).
POPIS PŘÍPADU
Pětapadesátiletá pacientka, absolventka matematicko-fyzikální fakulty, původním povoláním učitelka, nyní v plném invalidním důchodu pro quadruparetickou a cerebelární formu DMO, vdaná, matka dospělé dcery. Do mé (Honzák) ambulantní péče v IKEM se dostala před třemi roky pro úzkostné a depresivní potíže, které se zvýraznily v souvislosti s těžkým somatickým onemocněním manžela. Pečovala o něj doma, pokud nebyl v kritickém stavu opakovaně léčen na jednotce intenzivní péče, kam za ním zase téměř denně dojížděla 100 kilometrů.
Pod touto manifestní symptomatologií byla od počátku patrná osobnostní problematika táhnoucí se od dětství; postižené dítě nepřijaté rodinou, ve škole problémy s vrstevníky, ve 13 letech mentální anorexie s nutností hospitalizace na interním oddělení, zpočátku s parenterální realimentací (umělou výživou). Na VŠ údajně bez větších problémů. Debaklový partnerský vztah, v němž se narodila dcera. Druhé manželství již bezdětné, manžel však přijal dceru velmi dobře. Nicméně ta, jakmile dosáhla dospělosti, od rodiny odešla a kontakty jsou minimální, komunikace s matkou vždy konfliktní.
V současnosti manipulativní jednání, dramatické sebeobviňování, snaha po kontrole všech vztahů, a v důsledku toho prakticky sociální izolace. Přetrvávající atypické stravovací zvyklosti s tendencí redukovat hmotnost svéráznými způsoby, což nabylo na intenzitě po kontaktu s naší nutriční terapeutkou, s níž začala sehrávat typické berneovské hry s jídlem a váhou jako hlavními rekvizitami. Přitom s výjimkou přechodné horní dyspepsie (bolestí horní části trávicího traktu) v roce 2005, pro kterou byla několik dní hospitalizována na interním oddělení v bydlišti a která byla diagnostikována jako konverzní stresová reakce, žádné trávicí problémy neuvádí, jenom jí to „nechutná“.
Na emoční labilitu nasedaly epizody depresí s výraznou úzkostnou příměsí, a to jak situačně, tak nezávisle na okolnostech. Dominantním příznakem byla porucha spánku, částečně umocňovaná ničemným denním režimem s extrémně prodlouženou spánkovou fází, s tendencí zneužívat benzodiazepiny, což se podařilo omezit a nahradit je tlumivými antidepresivy a nízkými dávkami antipsychotik (melperon, quetiapin). Při použití kritérií MKN-10 byly patrné všechny kardinální příznaky depresivní poruchy v mírné, někdy až střední intenzitě (17).
Měsíc před vypuknutím manické epizody byla pacientka tři týdny hospitalizována na Rehabilitační klinice 2. LF UK v Motole, kde užívala Lanzul (blokátor protonové pumpy), Torvacard (atorvastatin) a Vigantol (vitamin D3), které potom brala také doma. Předtím ale v srpnu a v říjnu dvě týdenní antibiotické kúry 2x1 mg amoxicilinu. Psychiatrická medikace: mirtazapin 30 mg, trazodone 200 mg, melperon 25 mg, zolpidem 10 mg.
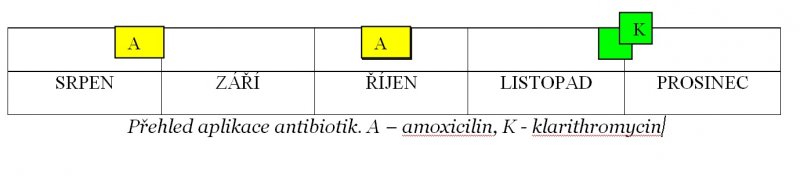
pacientka navštívila svoji praktickou lékařku, u níž si stěžovala na úporný dusivý kašel bez expektorace (vykašlávání), který ji v noci budí a přes den vysiluje. Na léčbu zjištěné bronchopneumonie jí byl předepsán klarithromycin v doporučené dávce 2 × 500 mg. Po prvních dvou dávkách se pacientka o půlnoci probudila s pachutí v ústech a s pocitem, že má „energie na rozdávání“. Od té chvíle se u ní projevuje zvýšené psychomotorické tempo, překotné myšlení s megalomanickými prvky. 30. 11. mi píše přes e-mail: Ty moje současný tělesný potíže jsou prd proti tomu, co se se mnou od páteční půlnoci děje. Jsem v hrozným průšvihu! Je mi úplně jedno, že máte zítra 22 + více lidí, prosím Vás, absolutně nutně!!! s Vámi potřebuji zítra mluvit!!! 1. 12. se koná setkání v IKEM spolu s manželem pacientky, který popisuje manický stav své ženy: Od pátku jako kdyby ožila, dostala novou sílu, poletovala po bytě, pořád jenom mluvila… Objektivně je pacientka výrazně zrychlená, logorhoická (nadměrně hovorná), zabíhavá, občas neudrží determinující tendenci. Megalomanie, pochopila konečně celou matematiku a doma to sepisuje, už počmárala jeden kroužkový blok, může to sepsat také anglicky, protože tento jazyk se jí vynořil a zvládá jej jako češtinu, zatím je to tam páté přes deváté, bez gramatiky. Všechna psychofarmaka od pátku vysadila. Předepisuji 2x10 mg olanzapinu a 3x300 mg lithia, což pacientka doma vůbec nevzala. Protože nespavost, a hlavně expanzivní jednání eskaluje až do brachiálních (násilných) konfliktů s manželem, je urgentně přijata do Psychiatrické nemocnice v Bohnicích. 2. 12. Při příjmu: Pacientka vigilní (bdělá), lucidní (s jasným vědomím), orientována správně časem, místem, osobou, částečně správně nahlíží i na svou situaci, dnes již klidnější a spolupracující, vyhoví verbální výzvě, odpoví na dotazy, většinou však obsáhle, zabíhavě, někdy zcela neudrží determinující linii, obtížně soustředí pozornost, referuje zvýšenou energii a sníženou potřebu spánku v domácím prostředí – vztahuje to na somatické potíže, kdy měla kašel. Poté náhle upadá do agresivního afektu, navzdory předchozím jasným dohodám křičí, že tu nemá co dělat, napadá personál holemi, rozrušená, neklidná neusměrnitelná. Suicidální (sebevražedné) proklamace. Je proto nutné přijetí na oddělení zvýšené péče. Ordinace: olanzapin 10 mg, clonazepam gtts 5 mg pro die. 2.12. v 19:40 přijata na oddělení zvýšené péče: Po příchodu obtížná spolupráce, rezonantní (předrážděná), paranoidně nastavená, ohrožuje holemi personál, neusměrnitelná. Aplikována Zyprexa 10 mg i.m., při kontrole stavu je pacientka klidnější, plačtivá, za své chování se nepřímo omlouvá, popisuje pocity úzkosti – domlouváme se na podání clonazepamu, který užívala před několika lety. Sděluje, že by se potřebovala vyspat, už asi od minulé středy pořádně nespí, připouští, že měla hodně energie, myšlenky jí rychle šly hlavou, bylo těžké se na ně soustředit, to je těžké i teď. 3. 12. Přeložena na oddělení pro afektivní poruchy, v zápisu uvedeno: Objektivně tempo stále urychleno, mnohomluvná, zabíhavá, odpovědi ale v relaci, tenze, myšlení překotné, ale souvislé, bez spontánní bludné produkce, nyní také už bez výrazné paranoidity, sebevražedné ideace nezachycuji. Náhled parciální přítomen. Léčebný a stabilizační pobyt, medikace jak nastaveno, tedy olanzapin 10 mg, clozapin gtts 30 kapek pro die, dále dle klinického stavu, vysazen klarithromycin, (Janoušková). 4.12. Pohovor: Je poprvé na psychiatrii v léčebně, do ambulance k dr. Honzákovi chodí asi čtyři roky, seznámili se v IKEM, kdy se tam léčil její manžel po trasplantaci slinivky. Dr. Honzák tam dělá konziliáře, má tam psychiatrickou ambulanci. Pak líčí, jak se v minulosti zhroutila (shodně s již uvedenými údaji). Tady je s léky spokojená, ráda by brzo domů… na návštěvy přijde někdy dcera nebo manžel, podle toho, jak se bude cítit. Psychomotorické tempo stále ještě mírně urychleno, (dál objektivní nález stejný). Plán: Léčebný a stabilizační pobyt, medikace dál taková, jak bylo nastaveno, snižovat Rivotril pozvolna, dále dle klinického stavu. Společné vycházky, psychoterapie – zatím červená (=lépe organizovaná) skupina. (Moravcová) Záznam sestry: Komunikativní, obšírně hovoří o sobě a svých potížích, vstřícná, chce být aktivnější, byla na vycházce s personálem, sama udává, že se cítí dobře, uvolněná, dobře se jí chodí (Pilátová). 5.12. Je patrné další zklidnění psychomotorického tempa. 6.12. Záznam sestry: Spala klidně celou noc, při kontrolách nereagovala na přítomnost personálu, v 6:00 šla na WC, rovná chůze o berlích, poté opět uléhá do lůžka (Čejková). 8. 12. (po víkendu): Subjektivně na komunitě udává, že tady je pořád z toho zmatená… neví co a jak (spíše manipulace než bezradnost – poznámka autora), ošetřující lékařka jí připomíná, že režim oddělení je tu vyvěšen a může se kdykoliv zeptat také kohokoliv z personálu. Na pohovoru: Byla za ní dcera, přinesla jí něco k snědku, ale všechno to nesnědla, s tím jídlem má pořád problémy, trvá to léta… ví, že musí jíst, pan doktor jí to pořád připomíná. Jinak nálada taková střídavá… spala docela dobře, s léky spokojená jakž takž. Doporučena aktivizace, pracovní terapie, pacientka to akceptuje. Objektivně: klidná, sedí v křesle s překříženýma nohama, což je její standardní posaz, forie (nálada) místy pokleslá, místy v normě, za začátku pohovoru situačně úzkostná, vyžaduje pozornost, myšlení koherentní, bez psychotické produkce, osobnost s akcentovanými rysy, tendence k manipulacím. Olanzapin 10 mg, Depakine 2x500 mg, Clozapin gtts celkem 15 kapek (Moravcová). 9.12. Celkové ladění i projev pacientky se prakticky neliší od toho, jak ji znám po tři roky. Mánie zcela ustoupila, do popředí se tlačí osobnostní psychopatologie s tendencemi manipulovat okolím. Dle sdělení sester „předvádí“ přehnané emoční projevy strachu o manžela, také „bezradnost“ nepůsobí věrohodně. (Honzák) 10.12. Subjektivně uvádí, že ta mánie odeznívá, už není tak rozlítaná a nemá tolik nápadů jako doma poslední čtyři dny, utlumená není, nálada se už blíží normě, někdy je i plačtivá, když ji něco rozruší, trochu hůř se jí artikuluje, v noci se probudila na močení, někdy hůř usíná. Asi dva týdny má více zkroucené ruce a nohy (spasmy – v.s. nízký přívod tekutin). Objektivně klidná, patrný ústup manické symptomatologie, forie místy pokleslá, místy v normě. Sklon k afektivní labilitě, vyžaduje pozornost, myšlení koherentní, bez psychotické produkce, spolupracuje, osobnost s akcentovanými rysy, má již kritický náhled. Koncentrace valproátu 940 umol/l – lék vysazen. (Moravcová) Další dny na oddělení v popředí histrionské (teatrální) projevy, emoční labilita, kolísání nálad, nepřekračují však ani do hypomanie, ani do deprese, odklonitelnost při zvýšeném zájmu téměř okamžitá, pak nastupují manipulační tendence. Demonstrativní „pády“ s okamžitou pomocí okolí, která ji pak „dojímá“. Spánek vcelku kvalitní, jídelní režim také. Při zprávě o chystaném propuštění se demonstrativně stupňují obavy o stav manžela, deklaruje, že má strach, že manžel umře (takže se bojí jít domů). Propuštěna ve stabilizovaném a dle mého soudu standardním stavu 23.12. Ordinace: olanzapin 15 mg, melperon 25 mg, pregabalin 150 mg a další interní medikace jako předtím. Zůstáváme na kontaktu přes email. (Honzák)
DISKUSE
Objeví-li se u pacientky s diagnózou osobnostní poruchy náhle epizoda mánie, je třeba pečlivě prověřit minulý průběh, zda se pod emočně labilní psychopatologií neskrývala bipolární porucha. Zejména tehdy, je-li v anamnéze prokázaná mentální anorexie. To není akademická úvaha, nýbrž důležitý moment eventuální korekce diagnózy a úpravy terapie (10,11).
Přestože v anamnéze pacientky byly patrné výkyvy nálady, nikdy nedosahovaly takové intenzity, že by zásadním způsobem zasahovaly do každodenní činnosti, sebepéče, nebo přesáhly hranice běžného sociálního chování. Podivuhodné stravovací zvyklosti s redukčními tendencemi, které jsou přetrvávajícím reliktem mentální anorexie v pubertě, se objevují nezávisle na převládající náladě, kdykoliv má pacientka pocit, že příliš přibrala a že ji nohy neunesou. Při nejlepší vůli též není možné zpětně diagnostikovat ani hypomanické epizody. Naprostá novost a neznalost podobného prožitku vyplývá i z e-mailu napsaného 30. 11. Také deprese byly většinou mírné, maximálně střední intenzity a vesměs vázané na nepříznivé okolnosti v životě pacientky.
Nepřítomnost bipolární poruchy může potvrzovat rovněž skutečnost, že pacientka byla v minulosti léčena někdy přechodně i vyššími dávkami antidepresiv II. – IV. generace, a nikdy nedošlo k přesmyku do mánie. To se stalo až po podání klarithromycinu. Tuto souvislost vidíme nejen jako časovou, ale také jako kauzální. Protože k tomu došlo až ve zralém věku, lze se přiklonit k názoru, že tyto epizody jsou častěji sekundárními epifenomeny, než pozdní manifestací bipolární poruchy (12). Také krátké trvání epizody a její snadné zvládnutí svědčí pro tuto etiopatogenezi.
Ke zvratu do mánie, pro nějž nabízíme novou hypotézu, si nejprve pracovně podchytíme jednotlivé prvky celého systému: klarithromycin a jeho účinky, možné lékové interakce, možné vlivy psychického a tělesného stavu, osa GUT – CNS a bakteriom s jeho předpokládanou účastí na rozvoji klinického obrazu.
Klarithromycin je antibiotikum ze skupiny makrolidů, příbuzné erytromycinu, s nímž sdílí i podobné spektrum antibakteriálního účinku, rozšířené ještě o účinnost na kmeny Mycobacterium avium, Mycobacterium leprae a některé další. Za významnou je v souvislosti s prezentovaným případem nutné považovat prokázanou skutečnost, že klarithromycin je schopen zásadním způsobem narušit rovnováhu střevního mikrobiomu (13). Makrolidy jsou zpracovávány systémem CYP 450, kde působí jako inhibitory 3A4, což vyvolává řadu lékových interakcí (14); erytromycin je výrazný inhibitor, clarithromycin je oproti němu slabší (15). Pokud jde o vybrané nežádoucí účinky z oblasti psychopatologie, příbalová informace pro uživatele (16) uvádí jako časté nespavost, méně časté spavost a zvýšenou svalovou dráždivost až křeče a jako ty, které „z dostupných údajů nelze určit“, zmatenost, depresi, halucinace a abnormální sny. Příbalový leták k preparátu KlacidÒ uvádí: Byly hlášeny přechodné poruchy centrálního nervového systému – anxiozita (úzkostnost), nespavost, noční můry, zmatenost, dezorientace, halucinace, psychózy a depersonalizace; příčinný vztah však nebyl zjištěn.
Při podrobné analýze možných interakcí, které by mohly vyvolat zvrat do mánie, jsme našli jako jedinou podezřelou kombinaci klarithromycinu se statinem (více v další části). Laboratorní nález (KO+biochemie) se neodchyluje od normy, mírné zvýšení kreatininu (91 µmol/l při normě 44–80) není z klinického hlediska podstatné, ani snížená clearance 1,10 ml/s (norma od 1,15 výše); přesto jako stabilizér nebylo zvoleno lithium, nýbrž valproát, ale i ten byl záhy vysazen. Pacientka nebyla dehydratovaná, nebyly zjištěny ani jiné známky, které by vedly k suspekci na delirantní symptomatologii. BMI po nástupu 18,5 (hraniční) při propuštění 19,5.
S ohledem na hypotézu, kterou nabízíme jako možné vysvětlení patogeneze pacientčina stavu, je třeba podrobněji zmínit ještě dva podstatné systémy, o nichž zatím není obecné povědomí: enterální nervový systém (ENS), někdy nazývaný „druhý mozek“ nebo také „gut brain“, a střevní mikrobiom.
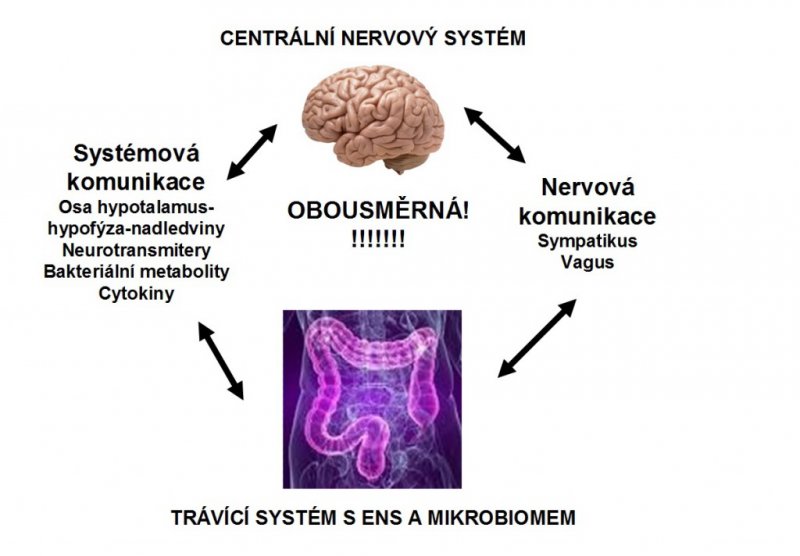 Vztahy mezi CNS, „útrobním mozkem“ a enterobiomem
ENTERÁLNÍ NERVOVÝ SYSTÉM A STŘEVNÍ MIKROBIOM
Trávicí systém je inervován jednak cestou spojení s centrálním nervovým systémem (CNS), jednak enterálním nervovým systémem (ENS). Ten obsahuje něco kolem 500 milionů neuronů, což je více, než jich má mícha, a je uložen ve stěně trávicí trubice jako Meissnerův submukózní a Auerbachův myenterický plexus (nervová pleteň). Svou složitostí a rozsahem je největší nervovou strukturou mimo CNS, s vysokou mírou autonomie a se zapojením řady neurotransmiterů (např. serotoninu) a regulačních peptidů. Podobně jako CNS má svou BBB – „blood-brain“ bariéru. Centrální nervový systém ovlivňuje trávicí trubici až po žaludek, ale v tenkém střevu a tračníku zajišťuje od svalové aktivity až po regionální krevní průtok vše ENS; jeho neuropatie může ohrožovat život, zatímco přerušení vagu nebo sympatických spojení nemá na trávicí pochody žádný vliv.
ENS pracuje v harmonii s reflexy CNS a signály z tohoto centra přicházejícími cestou přes sympatická ganglia, jimiž jsou řízeny trávicí pochody. Nervové signály mezi CNS a ENS probíhají obousměrně. Spojení mezi ENS a CNS se uskutečňuje prostřednictvím nervu vagu (bloudivého), pelvických (pánevních) nervů a cestou sympatiku, projekce neuronů ENS míří také do žlučníku, pankreatu (slinivky) a do trachey (18, 19). V důsledku toho je zajišťována nejen správná funkce trávicího systému, ale cestou ENS→CNS také jeho silný vliv na emotivitu a kognitivní funkce, včetně těch, které jsou považovány za intuitivní. Na druhé straně poruchy tohoto systému mohou vyvolat jak problémy v uvedených procesech, tak řadu trávicích problémů a chorob – od střevních zánětů a dráždivého tračníku po poruchy příjmu potravy nebo obezitu. Věda tak konečně začíná dohánět poznatky zachycené v trefných lidových rčeních.
Střevní mikrobiom (gut microbiota) obsahuje 1013 – 1014 bakterií, což představuje při jeho hmotnosti kolem 1,5 kg desetinásobek všech buněk našeho těla, ale jsou tam také viry, plísně a paraziti. Ve zdravém lidském střevu žije více než 500 druhů komenzálních, většinou anaerobních bakterií, především jsou zastoupeny jejich tři hlavní rody: Firmicutes, Actinobacteria a Bacteriodetes. Střevní mikrobiom je individuálně specifický a zakládá se u každého jedince při porodu vaginálními cestami; děti narozené císařským řezem mají chudší mikrobiom a v důsledku toho více imunitních a alergických problémů.
Mikrobiom přímo ovlivňuje ENS, a touto cestou pak také mozek. V obousměrné komunikaci hrají roli také neuropeptidy: substance P, CGRP – neuropeptid odvozený od genu pro kalcitonin, neuropeptid Y, vazoaktivní intestinální peptid, somatostatin a kortikoliberin (CRH). Mikrobiom sám produkuje řadu neurotransmiterů, počínaje GABA, přes serotonin, acetylcholin a konče nově popsaným agmatinem. Střevní mikroorganismy také mohou aktivovat přímo nervus vagus. Zdá se, že vagus rozlišuje mezi patogenními a nepatogenními bakteriemi, a to i v případě, že nejsou přítomny manifestní zánětlivé projevy. Podle charakteru stimulu mohou být výsledkem jak anxiogenní, tak anxiolytické účinky, některé signály modifikují imunitní odpovědi.
Dysmikrobie vede k narušení bariéry („leaky gut syndrome“) a má nepříznivý vliv na činnost CNS, emotivitu, kognitivní funkce, na vnímání bolesti, na imunitu a metabolismus. Je prokázáno, například na populacích bezmikrobních („germ-free“) zvířat, že úbytek některých významných bakterií vede k zhoršení gastrointestinálních, neuroendokrinních nebo imunitních funkcí, a nakonec k onemocněním (20-27). Přibývá rovněž důkazů, že střevní mikrobiom ovlivňuje stresovou osu hypotalamus-hypofýza-nadledviny (28).
Řada prací se věnuje přímo vztahům mezi mikrobiomem a některými psychickými poruchami a také možností jejich příznivého ovlivnění cestou úpravy zjištěné dysmikrobie. I zde však platí, že ovlivňování je obousměrné. Stres vede ke změnám v mikrobiomu: separační stres u mláďat k úbytku laktobacilů, stres v dospělosti k alteraci populace Bacterioides spp. a vzestupu interleukinu-6. Některé výsledky jsou rozporné, například u bezmikrobních myší je prokazatelně nižší úzkostnost, ale v kontrastu s tím větší aktivace stresové osy hypotalamus-hypofýza-nadledviny a také méně BDNF, zato vyšší koncentrace serotoninu i jeho prekurzoru tryptofanu v mozku. Když se jejich trakt kolonizuje, normalizuje se tryptofan, ale serotonin už ne (29). Otázkou také zůstává, nakolik lze nálezy u zvířat beze zbytku přenést do humánní oblasti.
Z psychických poruch, které by u lidí mohly souviset s alterací mikrobiomu, byly zkoumány především poruchy emotivity, autismus a schizofrenie a byly učiněny pokusy zlepšit klinický stav podáváním probiotik (26-32). U dětí trpících poruchami okruhu autistického spektra byly sice zjištěny odchylky ve skladbě mikrobiomu, výsledky jsou však jednak značně nekonzistentní (malé vzorky), jednak ne zcela validní vzhledem k různým dietám a farmakům, které mohou interferovat. Přestože byla několikrát shodně zjištěna dysmikrobie, narušení střevní bariéry a parciální ústup psychických i somatických obtíží po podání antibiotik, nelze z dosavadních prací dělat jednoznačné závěry.
Pokud jde o schizofrenii, je zjišťována dysfunkce střevní bariéry, zánětlivé a imunitní změny, senzitivita na antigeny některých potravin, což vše může být důsledkem střevní dysmikrobie. Užitečná by mohla být bezglutenová a bezkaseinová dieta, probiotika, eventuálně antibiotika. Zajímavé je čerstvé zjištění u zvířat, platné pravděpodobně také pro lidi, že olanzapin potencuje ve střevním mikrobiomu posun směrem k „obezitogennímu profilu“ (36).
Nejvíce studií se zaměřuje na úzkostné a depresivní příznaky. První poznatky, že bezmikrobní zvířata projevují méně úzkosti, byly rozšířeny o vlivy specifických diet na chování. Za prokázané lze považovat, že vysokotuková dieta navozuje u zvířat úzkost a depresi. Také jen přenos samotného mikrobiomu z těchto zvířat do bezmikrobních jedinců vede u nich k nárůstu úzkosti a deprese a k zvýšení permeability střevní stěny. Potvrzuje se také význam časných období pro vývoj mozku a pro riziko pozdější psychopatologie.
Racionale pro aplikaci mikrobiomu jako terapeutického agens vychází ze zjištění, že řada bakterií produkuje neurotransmitery, např. Lactobacillus a Bifidobacterium secernují GABA, Escherichia, Bacillus a Sacharomyces noradrenalin a Candida, Streptococcus, Escherichia a Enterococcus serotonin. Na tvorbě dopaminu se podílejí Bacillus a Serratia. Rovněž je zajímavé, že mikrobiom je schopen detekovat ve střevě Toxoplasma gondii a vyvolat proti němu imunitní reakci.
Termín „probiotika“ uvedli v roce 1965 do světa Daniel Lilly a Rosalie Stillewell (37) a nazvali tak látky produkované některými mikroby, které prodlužují životnost jiných bakteriálních druhů, jejichž účinek sice není tak výrazný jako inhibiční účinek antibiotik, ale může být delší. Navázali tak de facto na sto let starý Mečnikovův projekt potlačení „střevní autoinfekce“ mlékem fermentovaným pomocí Lactobacillus Bulgaricus. Probiotika stabilizují slizniční bariéru, zlepšují její imunitní schopnosti, brzdí růst některých bakterií a produkují antioxidační látky. Hlavní komerční přípravky obsahují hlavně Laktobacilli a Bifidobacteriae. Několik studií prokazuje ústup úzkostných a depresivních symptomů po podání probiotik a existují též práce uvádějící zlepšení příznaků únavového syndromu.
Vztahy mezi CNS, „útrobním mozkem“ a enterobiomem
ENTERÁLNÍ NERVOVÝ SYSTÉM A STŘEVNÍ MIKROBIOM
Trávicí systém je inervován jednak cestou spojení s centrálním nervovým systémem (CNS), jednak enterálním nervovým systémem (ENS). Ten obsahuje něco kolem 500 milionů neuronů, což je více, než jich má mícha, a je uložen ve stěně trávicí trubice jako Meissnerův submukózní a Auerbachův myenterický plexus (nervová pleteň). Svou složitostí a rozsahem je největší nervovou strukturou mimo CNS, s vysokou mírou autonomie a se zapojením řady neurotransmiterů (např. serotoninu) a regulačních peptidů. Podobně jako CNS má svou BBB – „blood-brain“ bariéru. Centrální nervový systém ovlivňuje trávicí trubici až po žaludek, ale v tenkém střevu a tračníku zajišťuje od svalové aktivity až po regionální krevní průtok vše ENS; jeho neuropatie může ohrožovat život, zatímco přerušení vagu nebo sympatických spojení nemá na trávicí pochody žádný vliv.
ENS pracuje v harmonii s reflexy CNS a signály z tohoto centra přicházejícími cestou přes sympatická ganglia, jimiž jsou řízeny trávicí pochody. Nervové signály mezi CNS a ENS probíhají obousměrně. Spojení mezi ENS a CNS se uskutečňuje prostřednictvím nervu vagu (bloudivého), pelvických (pánevních) nervů a cestou sympatiku, projekce neuronů ENS míří také do žlučníku, pankreatu (slinivky) a do trachey (18, 19). V důsledku toho je zajišťována nejen správná funkce trávicího systému, ale cestou ENS→CNS také jeho silný vliv na emotivitu a kognitivní funkce, včetně těch, které jsou považovány za intuitivní. Na druhé straně poruchy tohoto systému mohou vyvolat jak problémy v uvedených procesech, tak řadu trávicích problémů a chorob – od střevních zánětů a dráždivého tračníku po poruchy příjmu potravy nebo obezitu. Věda tak konečně začíná dohánět poznatky zachycené v trefných lidových rčeních.
Střevní mikrobiom (gut microbiota) obsahuje 1013 – 1014 bakterií, což představuje při jeho hmotnosti kolem 1,5 kg desetinásobek všech buněk našeho těla, ale jsou tam také viry, plísně a paraziti. Ve zdravém lidském střevu žije více než 500 druhů komenzálních, většinou anaerobních bakterií, především jsou zastoupeny jejich tři hlavní rody: Firmicutes, Actinobacteria a Bacteriodetes. Střevní mikrobiom je individuálně specifický a zakládá se u každého jedince při porodu vaginálními cestami; děti narozené císařským řezem mají chudší mikrobiom a v důsledku toho více imunitních a alergických problémů.
Mikrobiom přímo ovlivňuje ENS, a touto cestou pak také mozek. V obousměrné komunikaci hrají roli také neuropeptidy: substance P, CGRP – neuropeptid odvozený od genu pro kalcitonin, neuropeptid Y, vazoaktivní intestinální peptid, somatostatin a kortikoliberin (CRH). Mikrobiom sám produkuje řadu neurotransmiterů, počínaje GABA, přes serotonin, acetylcholin a konče nově popsaným agmatinem. Střevní mikroorganismy také mohou aktivovat přímo nervus vagus. Zdá se, že vagus rozlišuje mezi patogenními a nepatogenními bakteriemi, a to i v případě, že nejsou přítomny manifestní zánětlivé projevy. Podle charakteru stimulu mohou být výsledkem jak anxiogenní, tak anxiolytické účinky, některé signály modifikují imunitní odpovědi.
Dysmikrobie vede k narušení bariéry („leaky gut syndrome“) a má nepříznivý vliv na činnost CNS, emotivitu, kognitivní funkce, na vnímání bolesti, na imunitu a metabolismus. Je prokázáno, například na populacích bezmikrobních („germ-free“) zvířat, že úbytek některých významných bakterií vede k zhoršení gastrointestinálních, neuroendokrinních nebo imunitních funkcí, a nakonec k onemocněním (20-27). Přibývá rovněž důkazů, že střevní mikrobiom ovlivňuje stresovou osu hypotalamus-hypofýza-nadledviny (28).
Řada prací se věnuje přímo vztahům mezi mikrobiomem a některými psychickými poruchami a také možností jejich příznivého ovlivnění cestou úpravy zjištěné dysmikrobie. I zde však platí, že ovlivňování je obousměrné. Stres vede ke změnám v mikrobiomu: separační stres u mláďat k úbytku laktobacilů, stres v dospělosti k alteraci populace Bacterioides spp. a vzestupu interleukinu-6. Některé výsledky jsou rozporné, například u bezmikrobních myší je prokazatelně nižší úzkostnost, ale v kontrastu s tím větší aktivace stresové osy hypotalamus-hypofýza-nadledviny a také méně BDNF, zato vyšší koncentrace serotoninu i jeho prekurzoru tryptofanu v mozku. Když se jejich trakt kolonizuje, normalizuje se tryptofan, ale serotonin už ne (29). Otázkou také zůstává, nakolik lze nálezy u zvířat beze zbytku přenést do humánní oblasti.
Z psychických poruch, které by u lidí mohly souviset s alterací mikrobiomu, byly zkoumány především poruchy emotivity, autismus a schizofrenie a byly učiněny pokusy zlepšit klinický stav podáváním probiotik (26-32). U dětí trpících poruchami okruhu autistického spektra byly sice zjištěny odchylky ve skladbě mikrobiomu, výsledky jsou však jednak značně nekonzistentní (malé vzorky), jednak ne zcela validní vzhledem k různým dietám a farmakům, které mohou interferovat. Přestože byla několikrát shodně zjištěna dysmikrobie, narušení střevní bariéry a parciální ústup psychických i somatických obtíží po podání antibiotik, nelze z dosavadních prací dělat jednoznačné závěry.
Pokud jde o schizofrenii, je zjišťována dysfunkce střevní bariéry, zánětlivé a imunitní změny, senzitivita na antigeny některých potravin, což vše může být důsledkem střevní dysmikrobie. Užitečná by mohla být bezglutenová a bezkaseinová dieta, probiotika, eventuálně antibiotika. Zajímavé je čerstvé zjištění u zvířat, platné pravděpodobně také pro lidi, že olanzapin potencuje ve střevním mikrobiomu posun směrem k „obezitogennímu profilu“ (36).
Nejvíce studií se zaměřuje na úzkostné a depresivní příznaky. První poznatky, že bezmikrobní zvířata projevují méně úzkosti, byly rozšířeny o vlivy specifických diet na chování. Za prokázané lze považovat, že vysokotuková dieta navozuje u zvířat úzkost a depresi. Také jen přenos samotného mikrobiomu z těchto zvířat do bezmikrobních jedinců vede u nich k nárůstu úzkosti a deprese a k zvýšení permeability střevní stěny. Potvrzuje se také význam časných období pro vývoj mozku a pro riziko pozdější psychopatologie.
Racionale pro aplikaci mikrobiomu jako terapeutického agens vychází ze zjištění, že řada bakterií produkuje neurotransmitery, např. Lactobacillus a Bifidobacterium secernují GABA, Escherichia, Bacillus a Sacharomyces noradrenalin a Candida, Streptococcus, Escherichia a Enterococcus serotonin. Na tvorbě dopaminu se podílejí Bacillus a Serratia. Rovněž je zajímavé, že mikrobiom je schopen detekovat ve střevě Toxoplasma gondii a vyvolat proti němu imunitní reakci.
Termín „probiotika“ uvedli v roce 1965 do světa Daniel Lilly a Rosalie Stillewell (37) a nazvali tak látky produkované některými mikroby, které prodlužují životnost jiných bakteriálních druhů, jejichž účinek sice není tak výrazný jako inhibiční účinek antibiotik, ale může být delší. Navázali tak de facto na sto let starý Mečnikovův projekt potlačení „střevní autoinfekce“ mlékem fermentovaným pomocí Lactobacillus Bulgaricus. Probiotika stabilizují slizniční bariéru, zlepšují její imunitní schopnosti, brzdí růst některých bakterií a produkují antioxidační látky. Hlavní komerční přípravky obsahují hlavně Laktobacilli a Bifidobacteriae. Několik studií prokazuje ústup úzkostných a depresivních symptomů po podání probiotik a existují též práce uvádějící zlepšení příznaků únavového syndromu.
NAŠE HYPOTÉZA ZVRATU DO MÁNIE
Přestože psychopatologie, která se objevuje v příčinné souvislosti s podáním klarithromycinu, je známá již delší dobu, není zatím její vznik uspokojivě vysvětlen. V některých případech byly obviňovány interakce vznikající přes metabolický systém CYP450–3A4. Jak jsme zmínili v úvodu, současné podání statinů by také v našem případě mohlo hrát roli, protože ty jsou spolu s blokátory kalciového kanálu a kolchicinem v literatuře zmiňovány (38, 39). U naší nemocné však šlo o atorvastatin, jehož interakce byla specificky sledována (40). Autoři zjistili, že interakce clarithromycinu a atorvastatinu jsou klinicky nevýznamné, přičemž není rozdíl mezi expresory a non-expresory genu pro P450 3A4. Klarithromycin, respektive liposolubilní molekula jeho metabolitu 14-hydroxyklarithromycinu, může působit přímo toxicky na CNS. Je také možnost alterace kortizolového nebo prostaglandinového metabolismu, interakce s glutaminergními nebo GABA mechanismy, jak uvádí v souhrnné studii Shah se spolupracovníky. (41) Nicméně všechny tyto úvahy jsou na úrovni hypotéz. Vycházejíce z nových poznatků o funkci bakteriomu a z logické úvahy, která se nabízí, předkládáme další hypotézu možné patogeneze náhlého zvratu do mánie. Máme za to, že klarithromycin – nejčastěji v literatuře uváděný spouštěč podobných epizod – negativně ovlivnil střevní mikrobiom pacientky, který byl navíc již alterovaný dvěma kúrami amoxicilinu. Na základě dysmikrobie mohlo buď dojít k průniku molekul, které mohly působit na CNS jako „falešné neurotransmitery“, nebo mohla změna bakteriomu vést k přímé stimulaci nervu vagu a touto cestou i k nežádoucím procesům v CNS. Již před deseti roky Bartosch a její spolupracovníci prokázali u starších nemocných, kdy je přirozený pokles počtu střevních bakterií, že „antibiotická léčba u nich vede k další redukci střevních bakterií a k redukci jejich prevalence, u některých ke kompletní eliminaci určitých bakteriálních společenství. Naproti tomu u hospitalizovaných pacientů bez antibiotické léčby počet střevních bakterií (během hospitalizace) stoupal“ (42). Narušení způsobené antibiotiky se může reparovat až roky, takže lze předpokládat, že při zahájení léčby clarithromycinem nebyl bakteriom pacientky už zdaleka intaktní. Proč je právě klarithromycin nejčastějším spouštěčem manického zvratu, lze pouze spekulovat. Nejpravděpodobnější dvě možnosti jsou: baktericidní či bakteriostatická specifita k některé populaci střevního mikrobiomu, nebo toxicita jeho molekuly v případě zvýšené prostupnosti střevní stěny („leaky gut“). V každém případě lze s alterací bakteriomu a v důsledku toho také s narušením slizniční bariéry u naší pacientky počítat. A z 300 metrů čtverečních resorpční plochy střeva se toho může vstřebat dost. Myšlenka toxického působení falešných neurotransmiterů není nijak nová a před 40 roky jsem měl příležitost vidět (Honzák) pestré psychopatologické obrazy u pacientů s jaterní cirhózou po provedené portosystémové anastomóze poté, co navzdory zákazu snědli větší množství bílkovin. Tyto případy lze ještě dohledat v literatuře (43). K možnosti přímé stimulace vagu je třeba zopakovat, že tento hlavový nerv zprostředkovává signály nejen z ENS, ale také přímo z bakteriomu (20-25). K této úvaze nás jako určitý precedens přivedly zprávy o nežádoucích účincích terapie deprese a rezistentní epilepsie stimulací vagu. První případ, který jsme v literatuře zachytili, popsali v roce 2003 Klein et al. (44). Gerson se spolupracovníky (45) v přehledném článku uvádějí, že „hypomanické a manické symptomy jsou vzácné, ale známé nežádoucí účinky této léčby“, a popisují případ pacienta trpícího unipolární depresí, u něhož se během terapie rozvinula manická epizoda, která rychle odezněla, a po nějaké době bylo možno v této terapii pokračovat bez dalších problémů. Rozsáhlá multicentrická studie NIH (46) uvádí dva případy hypomanie nebo mánie po stimulaci vagu bez bližších podrobností. Čím vším může být vagus stimulován a co všechno může vagus stimulovat v CNS, je prozatím nejasné, stejně jako mnoho jiných okolností týkajících se dějů ve střevě. V úvahu přichází jak samotný klarithromycin, eventuálně jeho metabolit (viz ototoxicita streptomycinu), tak nedostatek nebo nadbytek některého z působků, nebo jenom jejich dysbalance. Jsme si vědomi toho, že naše hypotéza je na spekulativní úrovni, její slabou stránkou je skutečnost, že nevíme nic o stupni alterace, ani o rychlosti reparace mikrobiomu (resp. které jeho složky) po vysazení antibiotika. Zároveň ale máme za to, že představuje jedno z možných vysvětlení jevu, pro který zatím jednoznačné vysvětlení neexistuje. Prohlášení o střetu zájmů: žádný Adresa prvního autora: PN Bohnice, pavilon 27, Ústavní 91, 18 200 Praha 8-Bohnice. E-mail: radkinh@seznam.cz Literatura:
- Chen J., Fang Y., Kemp D. E., et al.: Switching to hypomania and mania: differential neurochemical, neuropsychological, and pharmacologic triggers and their mechanisms. Curr. Psychiatry Rep., 2010;12(6):512-21
- Baranowski W. J.: Clarithromycin-induced hypomania in a child - a case report. Acta Psychiatr Scand. 2010;122(3):267-268
- Abouesh A., Stone C., Hobbs W. R.: Antimicrobial-induced mania (antibiomania): a review of spontaneous reports. J. Clin. Psychopharmacol. 2002 Feb;22(1):71-81
- Fidan T., Fidan V.: Clarithromycin induced mania in a child. Int. J. Clin. Pharmacol., 2009;47(6):402-404
- Fonseca L., Ferreira P., Simoes S.: Clarithromycin induced mania. Ir J. Psych. Med. 2008;25(2):73
- Gomez Gil E., Gabilondo Cuellar A., Pablo Rabasso J. de: Three new cases of severe affective disorders induced by clarithromycin. Med Clinica, 2002;119(3):119
- Leclerq V., Lacaille S., Delpierre S., et al: Avoidable adverse event: carbamazepine encephalopathy when introducing clarithromycin. Rev. Med. Intern, 2005;26(10):835-836
- Lopes R., Rodrigues R., Domingues I., et al: Antibiomania: a case of a manic episode induced by clarithromycin. Acta Med. Port. 2011 Sep-Oct;24(5):827-32
- Ortíz-Domínguez A., Berlanga C., Gutiérrez-Mora D.: A case of clarithromycin-induced manic episode (antibiomania). Int. J. Neuropsychopharmacol. 2004;7(1):99-100
- Paris J., Black D. W.: Borderline Personality Disorder and Bipolar Disorder: What is the Difference and Why Does it Matter? J. Nerv. Ment. Dis. 2015 Jan;203(1):3-7
- Maurel M., Adida R., Belzeaux M., et al.: Troubles affectifs et troubles de la personnalité. L´Encephale, 2014;40(S3 ):S14-S17
- Liang C. S., Yang F. W.: Secondary mania associated with enterococcal meningitis in elderly. Gen. Hosp. Psychiatry, 2011;33(3):301.el-2
- Jakobsson H. E.1, Jernberg C., Andersson A. F., et al.: Short-term antibiotic treatment has differing long-term impacts on the human throat and gut microbiome. PLoS One. 2010 Mar 24;5(3):e9836
- Křížová M., Plecková M.: Riziko intoxikácie lithiom v kombinaci s antibiotickou terapiou. Psychiatrie pro praxi, 2004;(2):96-97
- Westphal J. F.: Macrolide-induced clinically relevant drug interactions with cytochrome P-450A (CYP) 3A4: an update focused on clarithromycin, azithromycin and dirithromycin Br. J. Clin. Pharmacol, 2000;50(4):285-295
- Příbalová informace pro uživatele sp.zn. sukls177334/2013
- Mezinárodní klasifikace nemocí. 10. revize. Duševní poruchy a poruchy chování. Psychiatrické centrum Praha, 1992
- Furness J. B., Callaghan B. P., Rivera L. R., Cho H. J.: The enteric nervous system and gastrointestinal innervation: integrated local and central control. Adv. Exp. Med. Biol. 2014;817:39-71
- Mayer E. A. Gut feelings: the emerging biology of gut-brain communication. Nat. Rev. Neurosci. 2011;12(8):453-66
- Clark J. A., Coopersmith C. M.: Intestinal crosstalk – a new paradigm
for understanding the gut as the “motor” of critical illness. Shock. 2007;28(4):384–393
- Forsythe P., Kunze W. A.: Voices from within: gut microbes and the CNS. Cell. Mol. Life Sci. 2013;70(1):55-69
- Mayer E. A., Knight R., Mazmanian S. K., et al.: Gut microbes and brain: Paradigm shift in neuroscience. J. Neurosci, 2014;34(46):15490-15496
- Bercik P1, Collins S. M., Verdu E. F.: Microbes and the gut-brain axis. Neurogastroenterol Motil, 2012;24(5):405-13
- Forsythe P1, Bienenstock J., Kunze W. A.: Vagal pathways for microbiome-brain-gut axis communication. Adv. Exp. Med. Biol. 2014;817:115-33
- Lyte M.: Microbial endocrinology: Host-microbiota neuroendocrine interactions influencing brain and behavior. Gut Microbes, 2014;(5):381-389,2014
- Tlaskalová-Hogenová H., Štěpánková R., Hudcovic T., et al.: Commensal bacteria (normal microflora), mucosal immunity and chronic inflammatory and autoimmune diseases. Immunol. Letters, 2004;93(2-3):97-108
- Tlaskalová-Hogenová H., Štěpánková R., Kozáková H.: Gut microbiota (commensal bacteria) and mucosal barrier in pathogenesis of inflammatory, autoimmune diseases and cancer: Contribution of germ-free and gnotobiotic models of human diseases. Cellular and Molecular Immunology, 2011;8(2):110-120
- Sudo N.: Microbiome, HPA axis and production of endocrine hormones in the gut. Adv. Exp. Med. Biol. 2014;817:177-194
- Cryan J. F., Dinan T. G.: Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat. Rev. Neurosci, 2012;13(10):701-12
- Fond G., et al. The „psychomicrobiotic“’: Targeting microbiota in major psychiatric disorders: A systematic review. Pathol. Biol. (Paris) (2014), http://dx.doi.org/10.1016/j.patbio.2014.10.003
- Vitetta L.1, Bambling M., Alford H.: The gastrointestinal tract microbiome, probiotics, and mood. Inflammopharmacology. 2014;22(6):333-339
- Bravo J. A., Julio-Pieper M., Forsythe P., et al.: Communication between gastrointestinal bacteria and the nervous system. Curr Opinion Pharmacol, 2012;12(6):667-672
- Foster J. A., McVey Neufeld K. A.:. Gut-brain axis: how the microbiome influences anxiety and depression. Trends Neurosci. 2013;36(5):305-312
- Luna R. A., Foster J. A.: Gut brain axis: diet microbiota interactions and implications for modulation of anxiety and depression. Curr. Opin. Biotechnol., 2015;22(1):35-41
- Nemani K., Hosseini Ghomi R., McCormick B., Fan X.: Schizophrenia and the gut-brain axis. Prog Neuropsychopharmacol Biol. Psychiatry. 2015;56(1):155-160
- Morgan A. P., Crowley J. J., Nonneman R. J., et al.: The antipsychotic olanzapine interacts with the gut microbiome to cause weight gain in mouse. PLoS One. 2014 Dec 15;9(12):e115225
- Lilly D. M., Stillewell R. H.: Probiotics: Growth-promoting facrors produced by microorganisms, Science. 1965,12;147(3659):747-748
- Ma T. K., Chow K. M., Choy A.S.M.: Clinical manifestation of macrolide antibiotic toxicity in CKD and dialysis patients. Clin. Kidney J., 2014;7(6):507-512
- Li D. Q., Kim R., McArthur E., et al.: Risk of adverse events among older adults following co-prescription of clarithromycin and statins not metabolized by cytochrome P450 3A4. CMAJ. 2014 Dec 22. pii: cmaj.140950. [Epub ahead of print]
- Shin J., Pauly D. F., Pacanowski M. A., et al.: Effect of cytochrome P450 3A5 genotype on atorvastatin pharmacokinetics and its interaction with clarithromycin. Pharmacotherapy. 2011;31(10):942-950
- Shah M., Subhani M., Rizvon K., Mustacchiab B.: Psychotic Episode Induced by Helicobacter pylori Triple Therapy Treatment. Case Rep Gastroenterol. 2012 May-Aug; 6(2):381–386
- Bartosch S., Fite A., Macfarlane G. T., McMurdo M. E.: Characterization of bacterial communities in feces from healthy elderly volunteers and hospitalized elderly patients by using real-time PCR and effects of antibiotic treatment on the fecal microbiota. Appl. Environ. Microbiol., 2004;70(6):3575-81
- Payne J. A.: False neurotransmitters and portal systemic encephalopathy. Clin. Neuropharmacol., 1982;5(3):267-75
44.. Klein J. P., Jean-Baptiste M., Thompson J. L., Bowers M. B. Jr. A case report of hypomania following vagus nerve stimulation for refractory epilepsy. J. Clin. Psychiatry 2003;64(4):485
- Gerson R.1, Murray E., Price B., et al.: Mania following vagus nerve stimulation: a case report and review of the literature. Epilepsy Behav., 2011;20(1):138-40
- Interventional procedure overview of vagus nerve stimulation for treatment-resistant depression
, (dohledáno 2. 1. 2015) Do redakce přišlo: 15. 1. 2015 K tisku zařazeno po recenzi 31. 1. 2015




